Principe et généralité d’une cellule photovoltaique de Graetzel
L’absorption du photon et le transport des charges sont dissociés dans la cellule à colorant.
La cellule est constituée de :
1 : verre transparent traité conducteur : SnO2dopé à la fluorine.3 : électrolyte : solution aqueuse à base d’iode I¯/I3¯
4 : colorant (S) à base de Ruthénium (RuL2(NCS)2)
5 : semi-conducteur = dioxyde de titane (TiO₂)
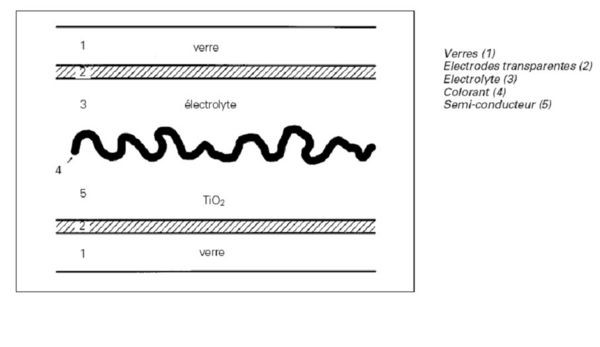
Le colorant, le semi-conducteur et le verre (en bas du schéma) constituent l’anode. La cathode est constituée du verre conducteur opposé (en haut du schéma).
Son fonctionnement est un cycle régénératif, c’est-à-dire qu’aucune substance est consommée ou produite durant le cycle:
I - un photon incident est absorbé par le colorant : S + hν -> S* ,
II - éjection d’un électron du colorant vers la bande de conduction du TiO₂ : S* -> S+ + e¯ ,
III - transport de l’électron dans le semi-conducteur et passage de l’anode vers la cathode par le circuit extérieur,
IV - transport de l’électron par réduction du triodure à la cathode : I3¯ + 2e¯ -> 3I¯ ,
V - régénération du colorant : 2S+ + 3I¯ -> 2S + I3¯ .
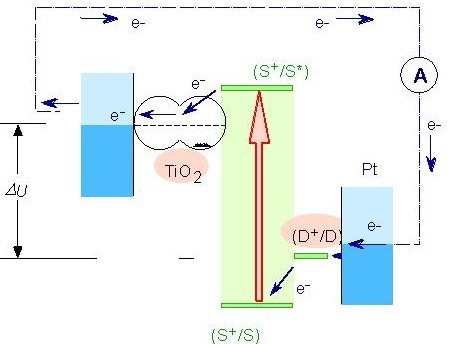
C’est la vitesse des réactions et des transferts de charge qui permet ce sens du cycle : le transfert des électrons du colorant au semi-conducteur doit être la réaction la plus rapide du cycle.
Propriétés des principaux éléments constituants la cellule :
-le semi-conducteur = dioxyde de titane (TiO2) :
-le semi-conducteur = dioxyde de titane (TiO2) :
-l’élément le plus important de la cellule
- utilisé dans l’industrie comme pigment blanc (peinture, crème solaire…). Il connut un fort engouement après la découverte en 1970, de son caractère photo-électrique et l’invention en 1991, par Graetzel, de cellules photovoltaïques organiques l’utilisant.
- sous trois formes cristallines dans la nature : anatase, rutile et brookite. Ici, sous forme anatase, qui est l’arrangement tridimensionnel d’octaèdre TiO6 . Cette forme possède une masse volumique de 3.84 g/cm³,
- possède un gap de 3.2 eV, et absorbe dans l’UV, qui pénètre peu l’atmosphère, d’où la nécessité d’utiliser un colorant pour le sensibiliser.
- le colorant :
-il doit avoir un spectre d’absorption le plus large possible et absorber dans le visible, car c’est le domaine de longueur d’onde qui pénètre le plus l’atmosphère,
- avoir une affinité forte avec le TiO₂, produire des électrons d’énergies équivalentes ou supérieures à celle de la bande de conduction de ce dernieret pouvoir les lui injecter facilement et très rapidement,
- enfin il doit pouvoir subir des millions de cycles d’oxydoréduction sans se dégrader. Les complexes de Ruthénium(RuL₂(NCS)₂) et d’Osmium sont de bons candidats.
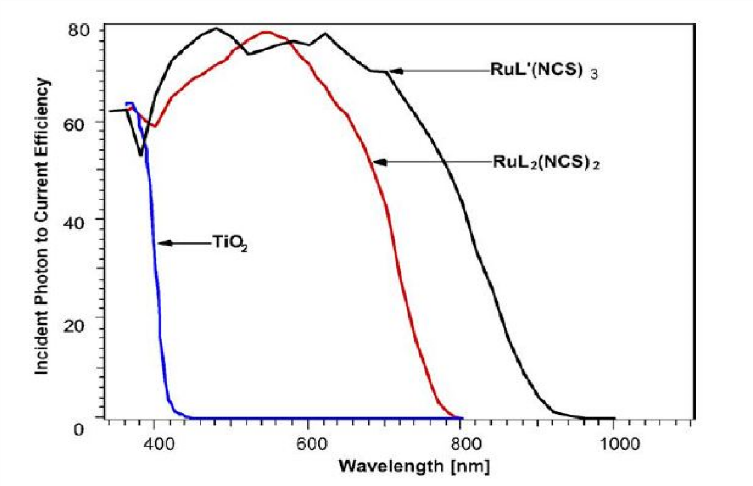
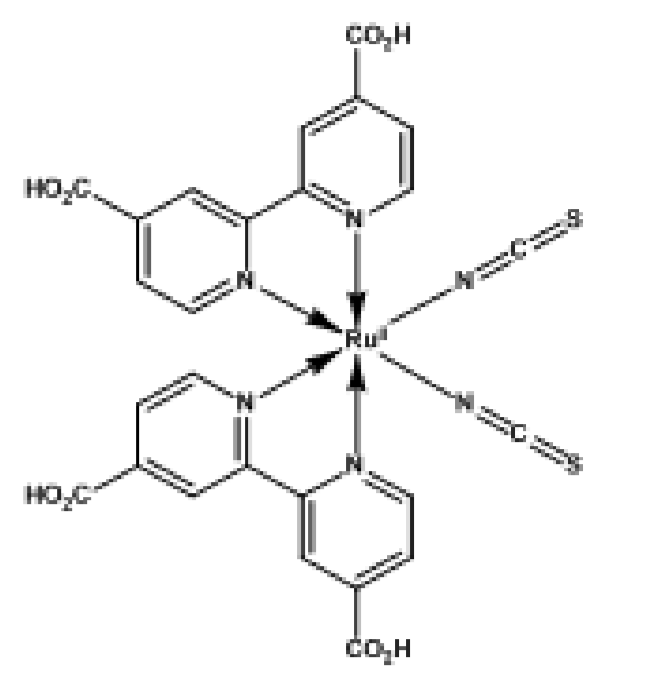
spectre d'absorption du TiO2 et de deux complexe au ruthénium molécule (RuL2(NCS)2)
